Carlos Urrego
Un grupo interinstitucional de docentes de la Universidad de Manizales, de Caldas y Católica desarrollan investigaciones para analizar la resistencia antimicrobiana en seres humanos, salud animal y producción animal.
“La vida siempre se busca un camino”… es una frase que se repite constantemente, pero, al parecer, hemos olvidado que bacterias, virus, parásitos y hongos también hacen parte de ese mundo biológico que se modifica, transforma y muta para sobrevivir en un espacio en la Tierra.
La Organización Mundial de la Salud, en un comunicado de prensa del 2017, alerta sobre “una grave carencia de nuevos antibióticos en fase de desarrollo para combatir la creciente amenaza de la resistencia a los antimicrobianos”. Una situación de suma importancia mantenida en silencio, y cuyas previsibles consecuencias afectarán la salud de millones de personas y animales.
El desarrollo de los antibióticos marcaron un antes y un después en la medicina; los médicos por fin tuvieron herramientas para atacar enfermedades como la tuberculosis o infecciones que aparecían luego de cirugías. Pero el uso indiscriminado, por ejemplo para tratar una gripa (debida a virus, no a bacterias) y la utilización masiva en la producción de vegetales, frutas y animales, ha ocasionado que la vida busque otros caminos y que estos microorganismos encuentren fórmulas para resistir los embates antimicrobianos.
Por esto, el Grupo de Resistencia Antibiótica de Manizales (GRAM), un esfuerzo interinstitucional liderado por un docente de la Universidad de Manizales, se centra en tres frentes: investigación científica, educación para el personal médico y vigilancia epidemiológica.
Uno de los primeros trabajos de GRAM fue revisar el perfil de resistencia de 7 centros hospitalarios de Manizales de tercer nivel con el apoyo de la Dirección Territorial de Salud de Caldas (DTSC); analizaron 7602 exámenes de susceptibilidad en urgencias, servicios de hospitalización, consulta externa y cuidado intensivo, con el objetivo era revisar qué tipo de bacterias se encuentran allí y cuál es su nivel de resistencia a antibióticos.
Sebastián Hernández Botero, médico microbiólogo, docente de la Universidad de Manizales y maestrante en Biología Computacional y Bioinformática, explicó que con estos datos han “empezado a ver cómo nuestro perfil de resistencia se parece en algunas cosas a Medellín o Bogotá pero es muy diferente en otros aspectos”, lo que resalta la necesidad de realizar estudios locales para identificar las resistencias y tomar decisiones médicas.
En esta primera investigación, por ejemplo, GRAM encontró que la infección más tratada en todas las instituciones de la ciudad es la de vías urinarias; la Escherichia coli, relacionada con enfermedades gastrointestinales y diarrea, es la bacteria más aislada. Otros resultados relevantes destacan la amplia resistencia a algunos tratamientos rutinarios tanto en hospitalización como en urgencias. Es así como la resistencia a cefalosporinas de primera generación, trimetoprim sulfametoxazol y ciprofloxacina (aplicadas en enfermedades como la tuberculisis), oscila entre un 15 y 20%, siendo este último antibiótico de reserva para algunas infecciones graves. No obstante, se encontró que la resistencia a la nitrofurantoina y fosfomicina es inferior al 3%, resultado que puede aportar a los médicos sobre la terapia antibiótica de elección en la infección bacteriana más frecuente en nuestra ciudad.
Esta información “permite a los profesionales de la salud elegir los antibióticos más efectivos para tratar las infecciones más comunes, basados en la evidencia de nuestros datos”, contó Isdruval Arengas Castilla, profesional especializado área de la salud de la DTSC. Ahora lo que buscan es avanzar en el perfil de resistencia para todo el departamento y construir protocolos y guías para mejorar la eficacia de las decisiones médicas.
Juan David Salazar Ospina, miembro fundador del proyecto por parte de la U. de Caldas, opinó que “con los datos que estamos obteniendo, por primera vez, la ciudad cuenta con análisis propios, porque tradicionalmente trabajamos con datos conjuntos con Bogotá o el resto del país. Nos hemos percatado de las diferencias y, por ende, de las distintas decisiones terapéuticas”.
Tuberculosis
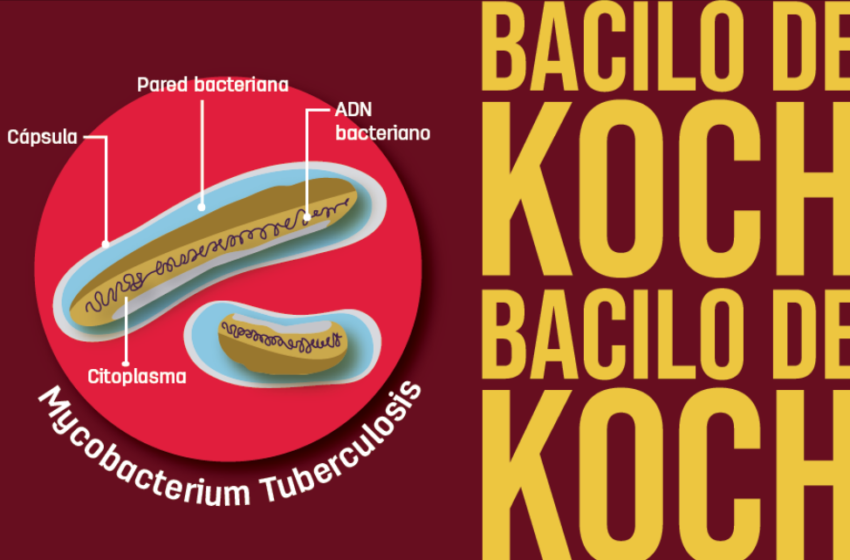
Desde finales del siglo XIX, gracias al trabajo de Robert Koch, se encontró que el Mycobacterium tuberculosis, conocido también como bacilo de Koch, es el agente causante de esa enfermedad, que incluso hoy en día le quita la vida a unos dos millones de personas cada año. Durante el 2018 en Caldas se identificaron 264 casos.
Bajo el microscopio, este bacilo se ve alargado como un tubo y su funcionamiento es, por lo menos, curioso. Generalmente una bacteria se divide en minutos, pero a este bacilo le toma hasta unas 20 horas. Requiere el oxígeno, por eso se conoce como aerobia obligatoria y se siente muy cómoda en la parte alta de los pulmones. Además, cuenta con una pared celular muy resistente, como una cera, lo que dificulta su erradicación; mientras nuestras envolturas naturales en las células tienen unos 20 carbonos, el Mycobacterium tuberculosis cuenta hasta con 90.
“Esperamos establecer un mapeo de la resistencia microbiana
en algunos de los microorganismos más frecuentes que afectan tanto animales como humanos”. Alejandro Ceballos.
Así como la Helibacter Pilory es común en nuestros estómagos, el bacilo de Koch lo es en nuestros pulmones; por un estornudo en un bus se pueden infectar un gran número de personas, pero para desarrollarse la tuberculosis se necesita de otros factores como un sistema inmune débil, diabetes, la vejez, etc.
Si los antibióticos no tienen efecto en estos pacientes “y deben tomar cuatro medicamentos y alguno de estos no funciona, empezamos a observar resistencias hasta llegar a tuberculosis multirresistentes”, esto es cuando incluso los antibióticos de última generación no logran detener a la bacteria. La OMS ha alertado sobre la tuberculosis multirresistente que, según este organismo, le quita la vida a unas 250.000 personas al año, además de la posibilidad de que esta situación aumente con el creciente flujo de inmigrantes provenientes de sistemas de salud ineficientes.
Por todo esto, GRAM adelanta una investigación en la que esperan secuenciar genéticamente aislamientos de tuberculosis de Chinchiná, un pequeño municipio al sur oriente de Caldas que es paso obligado de caficultores, agricultores e inmigrantes, y con una de las tasas más altas de VIH en el departamento; según datos de la DTSC, mientras que el promedio de prevalencia en el departamento es del 31,36 por cada 100.000 habitantes, en este municipio es de 95,94. Situación que tiene relación directa con la tuberculosis.
El objetivo de GRAM es secuenciar entre 20 a 40 muestras genéticas para conocer el estado de resistencia del bacilo de Koch en esta región del país, cuál es su origen y, posiblemente, confirmar una posible sepa colombiana, y con esa información proponer manejos terapéuticos.
La genética como diagnóstico
Pasar de las técnicas convencionales como la tinción -pintar de colores las bacterias, método desarrollado en 1884- o el cultivo, de unos 20 años después, por la secuenciación genética, genera ventajas como el aumento de la “seguridad para la persona que manipula los cultivos porque ya no tiene que estar en contacto con la bacteria. “Los datos de la secuenciación quedan en un repositorio mundial, y así aportamos conocimiento para empleo actual y en el futuro”, explicó Hernández.
Para combatir las bacterias multi-drogo-resistentes (MDR) es necesario obtener el mayor número de datos posibles y analizarlos; por ejemplo, mientras que en Perú se tienen miles de genomas secuenciados, Colombia apenas cuenta con algunas decenas.
“En un escenario terrorífico, llegan pacientes inmigrantes luego del colapso del sistema de salud de un país, por ejemplo alguien que haya estado en Asia o África y que esté infectado con un linaje un linaje foráneo (30% resistentes de antibióticos); con la secuenciación de ADN puedo saber su procedenia y así tomar una mejor decisión a la hora de escoger un tratamiento, pues si le aplico la terapia base, no lograré ningún efecto”, concluyó Hernández.
En animales
El tema de la resistencia a antibióticos ni empieza ni termina en los humanos. Durante años el ser humano ha utilizado estas moléculas para mejorar la producción de leche, hacer que los vegetales crezcan más rápido e incluso los insecticidas y pesticidas, que terminan en el suelo, modifican la genética de las bacterias, una combinación que puede afectar la salud.
Para entender este tema, GRAM está trabajando con el Centro de Especialistas Mascotas y el Grupo de Investigación de Leche y Epidemiología Veterinaria de la Universidad de Caldas, CLEV, para analizar qué ocurre en el departamento con las bacterias relacionadas con las infecciones en animales de compañía, y la mastitis. En las lecherías se han encontrado dos bacterias que afectan al ser humano y que han aumentado su resistencia a antibióticos, destacó el rector de la U. de Caldas e integrante del grupo, Alejandro Ceballos Márquez.
“Lo que estamos haciendo con GRAM es trabajar con tres universidades juntas.
Hemos aprendido que al unir capacidades somos tan fuertes
como cualquier institución líder del país”. Sebastián Hernández
“En la medicina veterinaria siempre ha existido una preocupación constante porque el consumo cárnico por parte de humanos también pueden afectar este problema de resistencia a los antibióticos. Por eso es importante investigar sus efectos cuando se usan de manera indebida o indiscriminada en animales”, concluyó Ceballos Márquez.
La mejor forma de atacar un problema es conocerlo por sus causas; por esto, investigar las relaciones, estructuras y diferencias locales es una necesidad para combatir un problema mundial pero que cambia territorialmente y, al igual que las bacterias, de forma rápida y constante.
“En la medicina veterinaria siempre ha existido una preocupación constante porque el consumo cárnico por parte de humanos también pueden afectar este problema de resistencia a los antibióticos. Por eso es importante investigar sus efectos cuando se usan de manera indebida o indiscriminada en animales”, concluyó Ceballos Márquez.
Así funcionan los antibióticos
Estos medicamentos atacan de maneras distintas a las bacterias. En su mayoría se centran en la pared celular y los procesos químicos que allí ocurren; otros destruyen los ribosomas (los que hacen posible la expresión de los genes y el desarrollo de las proteínas) o algún componente de estas.
“Otra forma de clasificar a los antibióticos es en bactericidas y bacterioestáticos, porque no todos matan las células. Hay unos que impiden que la población bacteriana se siga multiplicando y el sistema inmune alcance a controlar al resto, mientras que otros sí las matan”, explicó el médico, Carlos Felipe Marín Díaz.